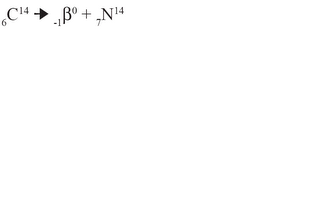Saturday, December 08, 2007

Friday, December 07, 2007

Wednesday, July 11, 2007
Tuesday, July 03, 2007

UFMS - 2008
(INVERNO 2007)
PROVA DE CONHECIMENTOS ESPECÍFICOS
(BIOLÓGICAS)
PROVA TIPO A
16) CH3 - COOH + HO - CH2 - CH3 ====== CH3 - COO - CH2 - CH3 + H2O
- d ácido = 1,05 g/mL e V ácido = 30 mL --- m ácido = 31,5g --- n ácido = 31,5/60 =
- 0,525 mol
- d etanol = 0,8 g/mL e V etanol = 28,75 mL ---- m etamol = 23g --- n etanol = 23/46 =
- 0,500 mol
- d éster = 0,9g/mL e V éster = 44 mL ---- m éster = 39,6g --- n éster = 39,6/88=
- 0,450 mol
CH3 - COOH + HO - CH2 - CH3 ======== CH3 - COO - CH2 - CH3 + H2O
0,525 mol ---------- 0,500 mol ------------------------ 0,450 mol
001 - o reagente limitante é o álcool, pois apresenta menor nº de mols (0,500 mol).
002 - foram formados 39,6g de acetato de etila (éster).
004 - com rendimento de 100%, 0,500 mol de éster deveria ser produzido.
- 0,500 mol éster --------------- 100%
- 0,450 mol éster ---------------- X
- X = 90%
008 - o álcool é o reagente limitante e deve ser consumido totalmente na reação.
016 - foram consumidos 0,500 mol de álcool ( m = 23g ).
032 - o excesso de ácido é 0,025 mol ( m = 1,5g ).
17) d HfO2 = 9,68 g/mL e M. at Hf = 176,5 u e M. at O = 16 u
- Massa molecular HfO2 = 176,5 + (2. 16) = 208,5 u
- Massa molar HfO2 = 208,5g/mol
001 -
- 1 mol HfO2 ---------------- 208,5g
- X ------------------------------ 1g
- X aprox. = 4,8 . 10 -3 mol
002 - 1 cm 3 de HfO2 ------- massa HfO2 = 9,68g
- 6 . 10 23 at. de Hf ------------- 208,5g
- X ----------------------------------- 9,68g
- X aprox. = 2,78 . 10 22 átomos Hf
004 - uma unidade de HfO2 = uma molécula de HfO2
- 6 . 10 23 molec. HfO2 ---------- 208,5g
- 1 molec. HfO2 -------------------- X
- X = 3,475 . 10 -22 g
008 - 1u = 1/12 carbono 12 = 2 . 10 -23 / 12 = 1 . 10 - 23 / 6
50 unidades de HfO2 = 50 moléculas
massa de uma molécula de HfO2 = 3,475 . 10 -22 g
massa de 50 moléculas HfO2 = 50 . 3,475 . 10 -22 = 173,75 . 10 -22 g
massa das unidades (u) = 1,0425 . 10 4 . (1 . 10 -23 / 6) = 173,75 . 10 -22 g
016 - 6 . 10 23 átomos pessam 176,5 g.
032 - uma molécula de HfO2 pessa 208,5 u.
18) 20 mL de gasolina ----- 23% álcool ------- 4,6 mL álcool / 15,4 mL gasolina pura
001 - álcool hidratado é uma mistura homogênea.
002 - gasolina pura é uma mistura homogênea de octano e aditivos.
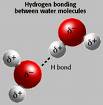
004 - o álcool é mais solúvel na água devido as fortes pontes de hidrogênio formadas com a água.
008 - em 20 mL de gasolina (23% de álcool), 4,6 mL é álcool anidro e 15,4 mL é gasolia pura.
016 - água é uma substância composta.
19) n N2 = 2,8 / 28 = 0,1 mol -------- V N2 = 0,10 L
n O2 = 6,4 / 32 = 0,2 mol --------- V O2 = 0,25 L
n CO2 = 8,8 / 44 = 0,2 mol --------- V CO2 = 0,50 L
T=27°C = 300K
001 - p N2 . V = n N2 . R . T
- p N2 . 0,1 = 0,1 . 0,082 . 300
- p N2 = 24,6 atm
002 - p O2 . V = n O2 . R . T (pressão somente do O2 na mistura)
- p O2 . (0,10 + 0,25) = 0,2 . 0,082 . 300
- p O2 = 14,06 atm
004 - após o procedimento I : Pt = p O2 + p N2
- p N2 . V = n N2 . R . T
- p N2 . (0,10 + 0,25) = 0,1 . 0,082 . 300
- p N2 = 7,03 atm
- Pt = 14,06 + 7,03 = 21,09 atm
008 - p CO2 . V = n CO2 . R . T (pressão somente do CO2 na mistura)
- p CO2 . (0,25 + 0,50) = 0,2 . 0,082 . 300
- p CO2 = 6,56 atm
016 - achando n da mistura O2 + N2, após procedimento II
- Pmistura . V recipiente (N2) = n mistura . R . T
- 21,09 . 0,25 = n mistura .0,082 . 300
- n mistura = 0,2143 mol
calculando a pressão parcial da mistura, após procedimento II
- Pm . V = n mistura . R .T
- Pm . (0,25 + 0,50) = 0,2143 . 0,082 . 300
- Pm = 7,03 atm
032 - após procedimento II: Pt = Pm + PCO2
- Pt = 7,03 + 6,56 = 13,59 atm
20) Transformação física não cria novas substâncias.
transformações químicas cria novas substâncias.
001 - Nas lâmpadas incandescentes, a corrente elétrica passa pelo filamento produzindo energia luminosa e calor, mas não ocorre reação química.
002 - A destilação fracionada é um processo físico de separação de substâncias em uma mistura gasosa.
004 - Muitas reações ocorrem sem mudança de cor:
- CO (g) + 1/2 O2 (g) ------- CO2 (g) (todos os gases são incolores)
008 - Na dissolução de um comprimido efervecente ocorre uma reação:
- NaHCO3 + H+ ( ácido ascórbico ) ------- Na+ + H2O + CO2
016 - A quimioluminescência é a emissão de luz ( onda eletromagnética ) por uma reação química ( oxidação lenta do fósforo ).
21)
001 -
- CH3 - CH (CH3) - COOH + HO - CH2 - CH2 - CH2 - CH3 (1- butanol) =========
CH3 - CH (CH3) - COO - CH2 - CH2 - CH2 - CH3 + H2O
002 -
- CH3 - COO - CH2 - CH2 - CH3 + NaOH ===== CH3 - CH2 - CH2 - OH + CH3 - COONa ( etanoato de sódio )
004 - Fenois são mais ácidos que a água, logo reagem com bases fortes formando fenóxidos. Os álcoois são menos ácidos que a água e não podem reagir com bases fortes.
008 - Álcool primário quando oxidado parcialmente forma aldeído.
- metanol + O2 ====== metanal + H2O
016 - Álcool primário quando oxidado totalmente forma ácido carboxílico.
- etanol + O2 ======== etanal + H2O + O2 ======= ac. etanóico + H2O (vinagre)
22)
001 - Quanto maior o número de elementos eletronegativos na molécula, maior a solubilidade em água (hidrossolúvel). Quanto menor o número de elementos eletronegativos na molécula, maior a solubilidade em gordura (lipossolúvel).
002 - O ácido salicílico pode fazer mais pontes de hidrogênio com a água, logo será mais solúvel.
004 - O ácido trifluoroacético é mais forte pois o efeito indutivo dos átomos de fluor liberam com mais facilidade os hidrogênios na forma H +.
008 - Moléculas simétricas são apolares e moléculas assimétricas são polares. No para-diclorobenzeno, como a molécula é simétrica, os monentos dipolares são cancelados (molécula apolar) e no orto-diclorobenzeno e no meta-diclorobenzeno as moléculas são assimétricas, os momentos dipolares não são cancelados (moléculas polares).
016 - O grupo nitro é elétron atraente e aumenta a acidez do ácido benzóico (efeito mesômero). Os radicais alquila são elétron repelentes e diminuem a acidez do ácido benzóico (efeito mesômero).
23)
001 - Poder calorífico é o calor liberado por kg de combustível
- 16g de metano ------------ liberam 890 KJ
- 1000g de metano -------- liberam X
- X = 55625 KJ/kg de metano
002 - Reação exotérmica = delta H é menor que zero
- H prod. - H reag. é menor que zero
- H prod. é menor H reag.
004 - energia de ligação = energia absorvida para quebrar 1 mol de ligação.
- para o metano - 1 mol de ligação C - H = 416 KJ
008 - C6H12O6 + 6 O2 ==== 6 CO2 + 6 H2O + 2800 kJ (exotérmico)
- 9 CO2 + 9 H2O + 4200 kJ ====== 3/2 C6H12O6 + 9 O2 (endotérmico)
016 - fotossíntese:
- 6 CO2 + 6 H2O + 2800 KJ ====== C6H12O6 + 6 O2 ( endotérmico )

RESOLUÇÃO DA PROVA = UFMS-2008
(INVERNO 2007)
- PROVA DE CONHECIMENTOS GERAIS - prova A
25) delta H (reação) = soma delta H form. prod. - soma delta H form. reag.
- delta H (reação) = [ (-394.2) + (-286)] - [(+227) + (0)]
- delta H (reação) = - 1301 KJ/mol
p/ 28Kg de acetileno
- 26g de acetileno --------------- - 1301 KJ
- 28000g de acetileno ---------- X
- X = 1401. 10 3 KJ = 1,401 . 10 6 KJ
resposta = E
26) V água = 0,5 L e D água = 1 g/mL , logo, M água = 500g
- M açucar = 1000g
- Pp = 100 . Título
- Pp = 100 . massa soluto/massa solução
- Pp = 100 . 1000/1000+500
- Pp = 66,66%
- Pp aprox. = 67%
resposta = D
27) etanol = CH 3 - CH 2 - OH
- C - H = sp 3 - s
- C - C = sp 3 - sp 3
resposta = C
28) Ka H 2 S = 9,1 . 10 -3
- Ka HS- = 1,2 . 10 -15
- Como Kh = Kw/Ka, quanto menor o Ka, maior deve ser o Kh.
- Logo, o Kh1 é maior que o Kh2.
- Kh1 sendo maior - apresenta maior [OH-]
resposta = B
29) No período de seca a floresta tem mais folhas = ocorre mais fotossíntese = ocorre maior produção de oxigênio.
resposta = A
30) óxido ácido + base --------- sal + água
- ácido + base --------- sal + água
- p/ remover o óxido ácido devemos utilizar uma base [ Me(OH) X].
resposta = C
Monday, January 29, 2007
- Curso de química com livro ( Ricardo Feltre ).
- Teoria e resolução de exercícios.
- Para os interessados:
* Clique em comments ( abaixo ).
* Digite e-mail e/ou fone para contato.
Thursday, December 21, 2006
- Questão 35
- A alternativa D é falsa.
* Todos sabem que os fenois são menos ácidos que os ácidos carboxílicos (regra geral).
* Cuidado!!!!!
O pH depende da concentração de H+.
Depende da ionização do fenol e da ionização do ácido acético.
Quanto maior a ionização - maior a concentração de H+ - menor o pH.
A concentração do fenol e do ácido acético determinam a concentração de H+.
- Questão 20
* A questão:
O potencial-padrão........ , a 298K.
A partir desses dados, analise as afirmativas a seguir, e assinale a (s) correta (s).
- Não foi citado no enunciado a presença da platina (Pt).
- O padrão convencional de representação simbólica, usado no ensino médio, não foi respeitado.
- Mn/Mn +2//Cl 2/2Cl-
Wednesday, December 13, 2006
- Nos processos de transmutação nuclear ocorre a conservação do nº de massa e do nº atômico.
- Nos processos de transmutação nuclear a massa não se conserva, parte dela se transforma em energia.
- EX:
* O nº de massa no reagente é = a soma do nº de massa nos produtos = 14
* O nº atômico no reagente é = a soma do nº de massa nos produtos = 6